文献导读:Enamine始终深耕科学研究领域,每年发表学术论文超70篇。本期特别聚焦一项重磅成果——公司首席科学家Pavel K. Mykhailiuk博士与K. Barry Sharpless教授联合通讯作者,2025年12月16日在线发表于顶刊《Nature Synthesis》的突破性研究论文。
烷基磺酰氟作为双亲试剂参与钯(II)催化未活化烯烃的立体选择性环丙烷化反应
摘要
本文报道了在钯(II)催化下,烷基磺酰氟作为双亲试剂与烯烃立体选择性合成多种环丙烷的反应。磺酰氟官能团在双亲试剂中同时充当酸化基团和内氧化剂,分别促成催化循环中连续的碳钯化和氧化加成步骤。该转化可高效合成顺式取代环丙烷,且对多种烷基磺酰氟具有广泛兼容性,包括含氰基(–CN)、酯基(–CO₂R)、异噁唑基、吡唑基和芳基的衍生物。对于内烯烃底物,该方法能以中等到良好的产率和可预测的非对映选择性,合成传统方法难以制备的1,2,3-三取代环丙烷。通过反应进程动力学分析和密度泛函理论计算获得的详细机理表明,SN2型碳-磺酰氟(C–SO₂F)氧化加成是反应的决速步和非对映选择性决定步。
引言
随着六价硫氟交换(SuFEx)化学的兴起,有机磺酰氟已成为有机合成中的核心试剂1-3。该化学通过氧、氮亲核试剂对氟离子的亲核取代,实现快速且可靠的分子多样化修饰4-6。在此背景下,有机磺酰氟的实用价值推动了大量高效、高选择性、模块化合成结构多样磺酰氟的方法开发7-11(图1a)。

与研究广泛的芳基磺酰氟12-17、烯基磺酰氟18-21和炔基磺酰氟11不同,烷基磺酰氟尽管因磺酰基对α-质子的酸化作用而具备作为合成砌块的独特潜力5,但其研究仍不够深入。近期,布尔团队开发了一系列优雅的氮杂环丁烷和氧杂环丁烷磺酰氟脱磺偶联反应,用于构建碳-杂原子键22,23。已有研究表明,在碱存在下,烷基磺酰氟可与烷基卤化物、羰基化合物等传统亲电试剂反应,实现碳-碳键构建16,17,24-30(图1b)。我们推测,利用磺酰氟基团兼具亲核试剂活化剂和亲电反应基团(内氧化剂)的双重作用,烷基磺酰氟在过渡金属催化中可能展现出独特的双亲反应性。
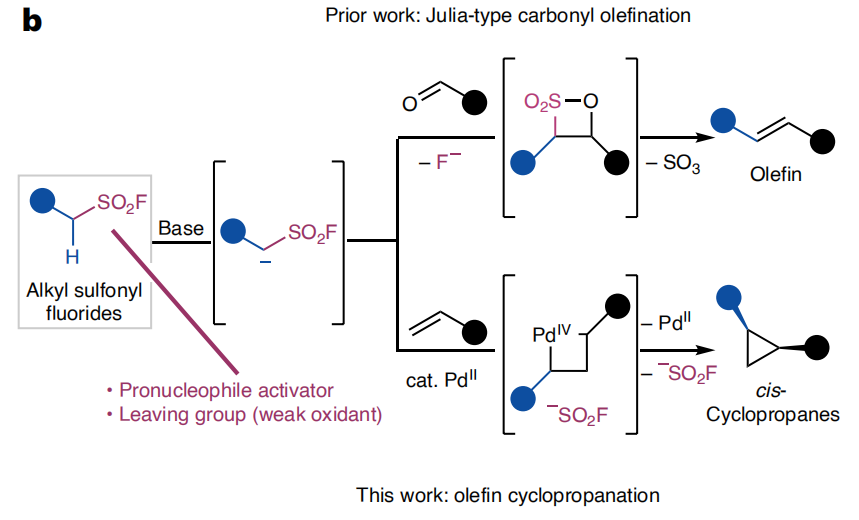
本实验室此前开发了钯催化下多种碳亲核试剂与烯烃的反式环丙烷化反应,其机理被认为涉及亲核试剂的初始 α-碘化、导向碳钯化、新形成的碳(sp³)-碘键的钯(II)/钯(IV)氧化加成,最终从钯杂环丁烷中间体发生碳(sp³)-碳(sp³)还原消除31。该方法除硝基甲烷外,均需双活化碳亲核试剂,这限制了可获得的取代环丙烷的范围,促使我们寻找将离去基团和酸化基团融合为同一实体的新型亲核偶联伙伴。
本文中,我们证实了烷基磺酰氟通过钯(II)/钯(IV)氧化还原对,在未活化烯烃的立体选择性环丙烷化反应中充当双亲偶联伙伴。该催化循环利用了一种新颖的反应模式——碳(sp³)-磺酰氟键向有机钯(II)中间体的氧化加成,实现了传统离去基团无法获得的立体化学结果32-35(图1b)。本文修订期间,Mane和Baidya报道了一种导向环丙烷化反应,利用酮衍生的锍叶立德合成相关的顺式-1,2-二取代环丙烷产物36。
结果与讨论
反应条件优化
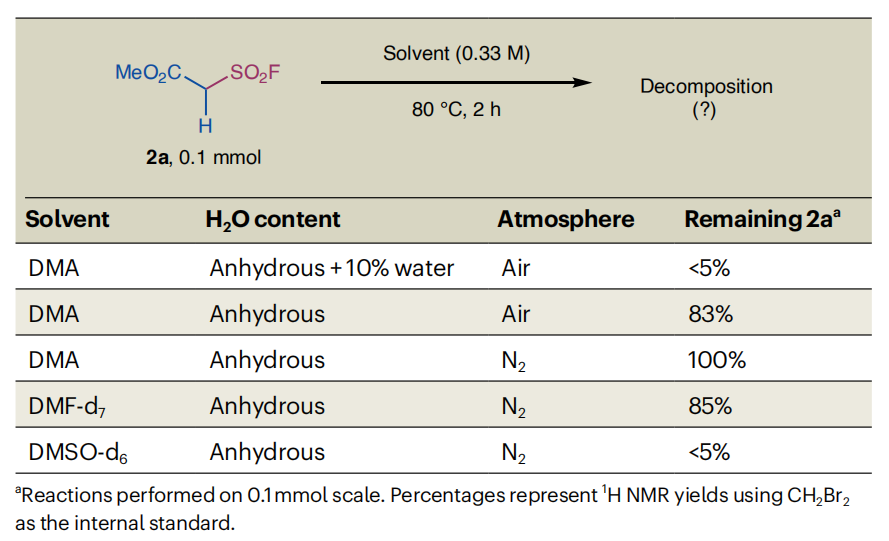
在此背景下,我们选择含反应所需的8-氨基喹啉导向基的烯基酰胺1a和烷基磺酰氟2a作为模型底物。经大量筛选,确定最优反应条件:在氮气氛围下,以乙酸钯(Pd(OAc)₂,10摩尔%)为催化剂、碳酸钠(Na₂CO₃,1.0当量)为碱,在二甲基乙酰胺(DMA,0.33摩尔/升)中反应,环丙烷3aa的分离产率达94%,非对映异构体比例(d.r.)为98:2;单晶X射线衍射37-42证实了主要产物的特殊顺式构型(表1)。
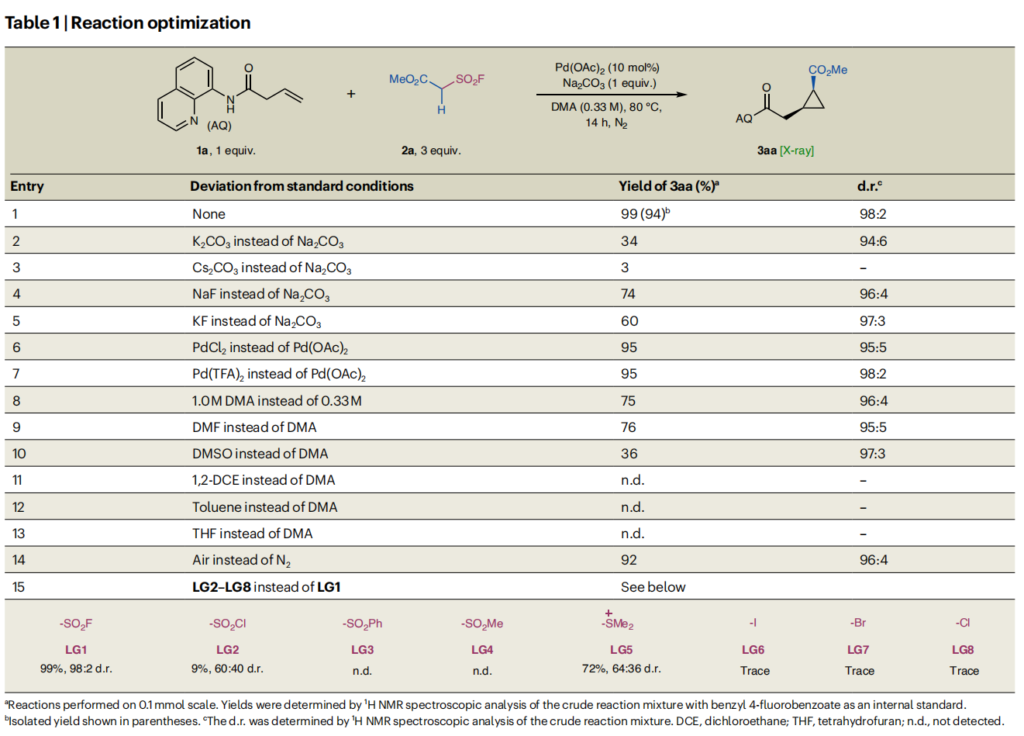
优化过程的关键发现包括:碳酸钠作为碱的重要作用——其他碳酸盐(如碳酸钾(K₂CO₃)、碳酸铯(Cs₂CO₃))及其他反荷阴离子的碱(如氟化钠(NaF)、氟化钾(KF))均导致产率显著降低(实验序号2-5);其他常用钯(II)源(如二氯化钯(PdCl₂)、三氟乙酸钯(Pd (TFA)₂))产率略低但非对映选择性相当(实验序号6-7);提高反应浓度会降低产率(实验序号8);极性非质子溶剂至关重要,二甲基甲酰胺(DMF)和二甲基亚砜(DMSO)是DMA的有效替代溶剂(实验序号9-13);令人欣喜的是,即使在空气氛围中使用无水DMA,反应仍能获得92%的产率(实验序号14)。
对照实验表明:将离去基团替换为磺酰氯(LG2)、苯磺酰基(LG3)或甲磺酰基(LG4)时,反应无产物或仅产生痕量产物(实验序号15),证实磺酰氟是观察到的反应的关键;代表性的溴化锍叶立德前体(LG5)产率中等但非对映选择性较差;卤化物等非硫基离去基团均无效。另一项对照实验显示,当2a在我们先前报道的钯(II)催化环丙烷化条件31下反应时,生成了一种不同的产物——磺酰氟基团(–SO₂F)保留的三取代环丙烷(详见支持信息中“钯(0)盐筛选与对照实验”部分)。
为合理化优化数据,我们参考了此前关于苯甲基磺酰氟(PMSF)等烷基磺酰氟在水溶液中极不稳定的报道43,推测不同条件下(不同溶剂、有无微量水)亲核试剂的竞争性分解可能是产率差异的部分原因。为此,我们考察了烷基磺酰氟2a在DMA、DMF和DMSO中的稳定性(详见表2及支持信息中“稳定性测试”部分)。令人意外的是,无水DMSO中2a在2小时内完全分解,而在无水DMF中相对稳定;惰性氛围下无水DMA中的2a无分解,但空气氛围下DMA中观察到中等程度分解,湿DMA中则完全分解。已有报道表明,有氧条件下DMA会氧化分解为N-甲基乙酰胺和甲醛44,这可能是导致上述现象的原因之一。这些结果表明,2a的分解速率取决于溶剂种类和溶液中微量水的含量。
底物范围拓展
烷基磺酰氟底物
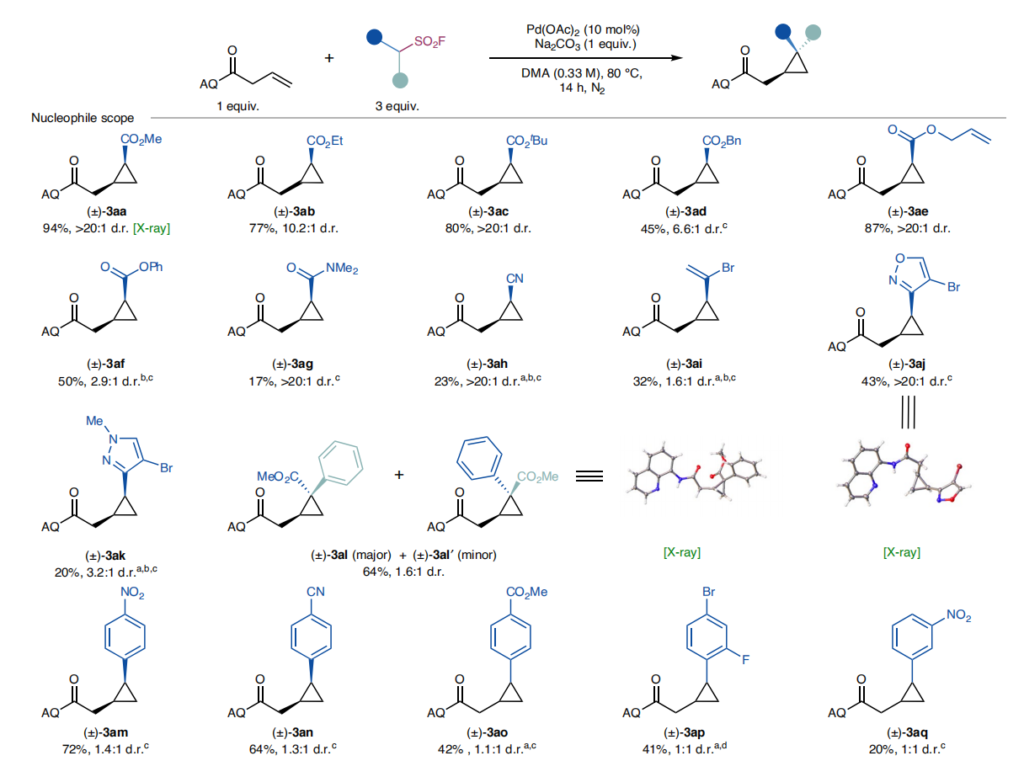
优化反应条件后,我们首先考察了烷基磺酰氟的底物范围(图2),其中多种底物可商购或通过常规方法轻松制备(详见支持信息中“起始原料制备通用流程”部分)。
酯类亲核试剂(3ab-3af):包括乙酯、叔丁酯、苄酯、烯丙酯和苯酯衍生物,反应产率中等至优异,均以高非对映选择性生成顺式环丙烷,且无明显的碱介导差向异构化45;
酰胺或腈类偶联伙伴(3ag-3ah):产率有所下降,但仍保持优异的顺式非对映选择性(>20:1);
弱吸电子基团及杂环取代底物(3ai-3ak):2-溴丙烯基、异噁唑基、1-甲基-1H-吡唑基取代的烷基磺酰氟均能兼容,产率分别为32%、43%和20%;
α-芳基烷基磺酰氟:能参与反应并在环丙烷中形成全取代碳中心,但产率和非对映选择性中等(3al);
芳基取代亚甲基磺酰氟(3am-3ap):未取代的电子中性苄基磺酰氟不反应,而对位含吸电子基团的取代苄基磺酰氟可顺利反应,且吸电子能力越强,产率和非对映选择性越高;间位硝基底物同样可耐受(3aq)。
烯烃底物
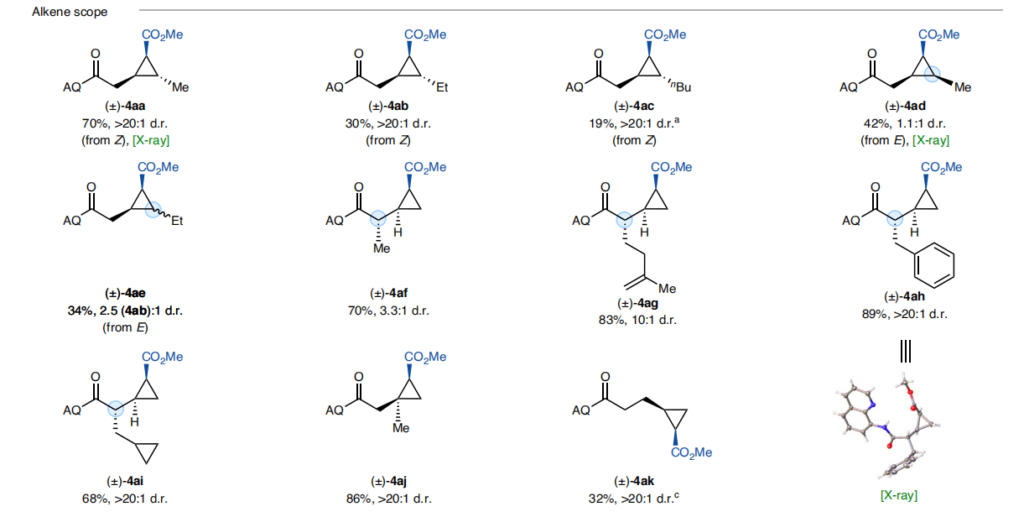
随后考察了烯烃的底物范围:
内烯烃(4aa-4ae):产率中等到良好;值得注意的是,(Z)-烯烃反应的非对映选择性优异(>20:1),仅生成单一非对映异构体;令人欣喜的是,在标准条件下,可通过(E)-构型内烯烃一步合成热力学和动力学上不利的全顺式环丙烷(4ad),产率中等,非对映异构体比例为1.1:1;
α-取代 β,γ-不饱和酰胺底物(4af-4ai):兼容性良好,产物产率中等至优异;
二烯烃底物(4ag):可在β,γ-烯烃位点发生化学选择性环丙烷化,而δ,ε-烯烃不受影响;
γ,δ-不饱和酰胺(4ak):延长烯烃与导向基之间的连接链后,反应仍能以中等产率和优异非对映选择性生成环丙烷产物。
合成应用扩展
规模放大(图3a):该方法易于放大,1.0毫摩尔规模下标准条件反应,顺式环丙烷3aa的产率为86%;100毫摩尔规模产率为81%,非对映异构体比例为9:1;
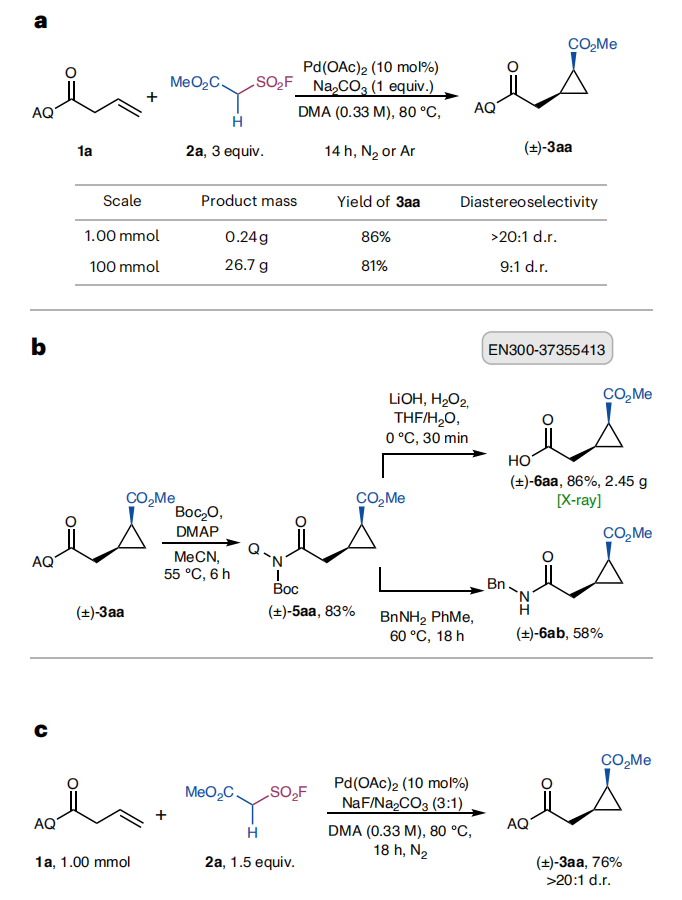
导向基脱除(图3b):通过两步序列可脱除导向基46:首先引入N-叔丁氧羰基(N-Boc)活化基团,产率83%(5aa);随后用过氧化氢氧化锂(LiOOH)/水水解,多克级规模下羧酸6aa的产率为86%,该产物已由enamine公司商业化;第二步也可使用代表性胺进行净转酰胺化反应(产率58%,6ab);
降低亲核试剂用量(图3c):采用双碱体系(0.75当量氟化钠和0.25当量碳酸钠),可将亲核试剂2a的用量降至1.5当量,同时保持相当的产率和非对映选择性(详见支持信息中 “低亲核试剂用量下的碱筛选” 部分)。
动力学研究
烷基磺酰氟在该环丙烷化反应中独特的反应性及观察到的立体化学结果,促使我们通过实验和计算技术探究其机理。我们采用反应进程动力学分析,以最少的实验确定反应的关键机理特征47。
首先,将标准反应曲线与模拟25%转化率的“相同过量”实验曲线对比(图4a)。时间平移分析显示,反应进行至约50%转化率时两条曲线重合,之后出现轻微偏离——提示存在轻度产物抑制或部分催化剂失活。为区分这两种可能性,我们进行了添加产物3aa(83毫摩尔)的对照实验,与相同过量实验曲线的重叠证实了轻度催化剂失活。考虑到产物可能以多齿方式与催化剂结合,无产物抑制的结果值得关注。为进一步探究产物与催化剂的潜在配位作用,我们将3aa与乙酸钯(1当量)反应,生成了N,N,C-钯杂环配合物Pd–3aa(图4b),X射线晶体学48证实该配合物中环丙基的C–H键被断裂。标准条件下,配合物Pd–3aa表现出催化活性,表明C–H活化具有可逆性,与无产物抑制的结果一致。

为估算反应组分的级数,我们进行了一系列“不同过量”实验(图4c)。考虑到高转化率下催化剂失活更显著,我们重点分析反应初期(转化率<50%)的数据。变量时间归一化分析49图显示,烯烃(1a)和亲核试剂(2a)均接近零级,乙酸钯接近一级。总体而言,动力学数据表明决速步可能是氧化加成或还原消除。
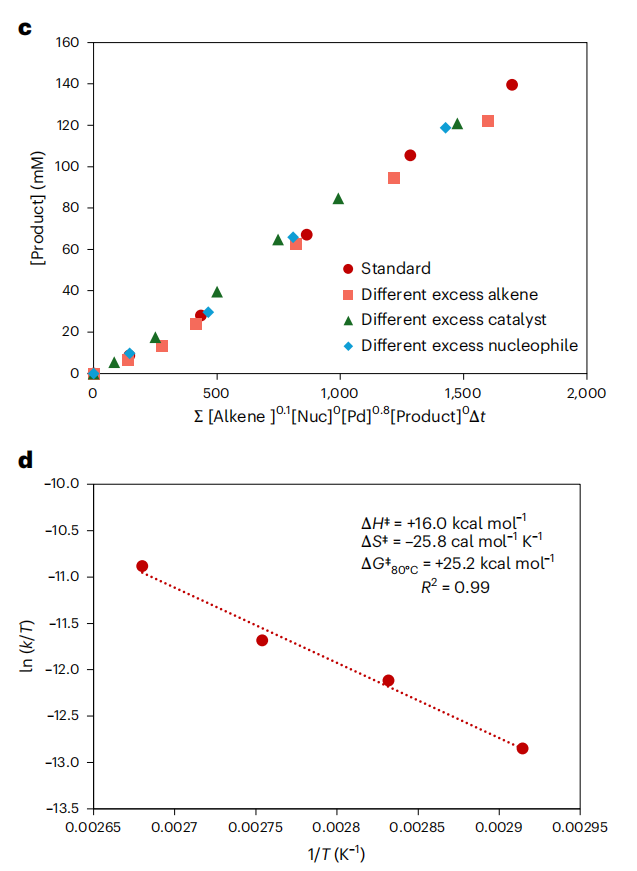
为深入探究决速步,我们通过艾林分析获得了活化参数(图4d)。在接近标准条件的温度范围(70-100℃)内,实验测定的活化熵(ΔS‡)为-25.8熵单位(e.u.),活化焓(ΔH‡)为16.1千卡/摩尔(80℃时的活化自由能 ΔG‡=25.2千卡/摩尔)。鉴于双分子缔合反应通常表现出较大的负活化熵50,而本体系的氧化加成和还原消除均为单分子步骤,该数据表明,从催化剂静止态到势能面上的决速过渡态,可能涉及配体与金属中心的去溶剂化和配位过程,这为后续的密度泛函理论(DFT)计算提供了参考。
计算研究
我们以烯烃1a和烷基磺酰氟亲核试剂2a为模型底物进行DFT计算,探究催化循环的多个方面,包括决速步和非对映选择性决定步(图5a),重点关注氧化加成机理及顺式环丙烷产物3aa的非对映选择性起源。
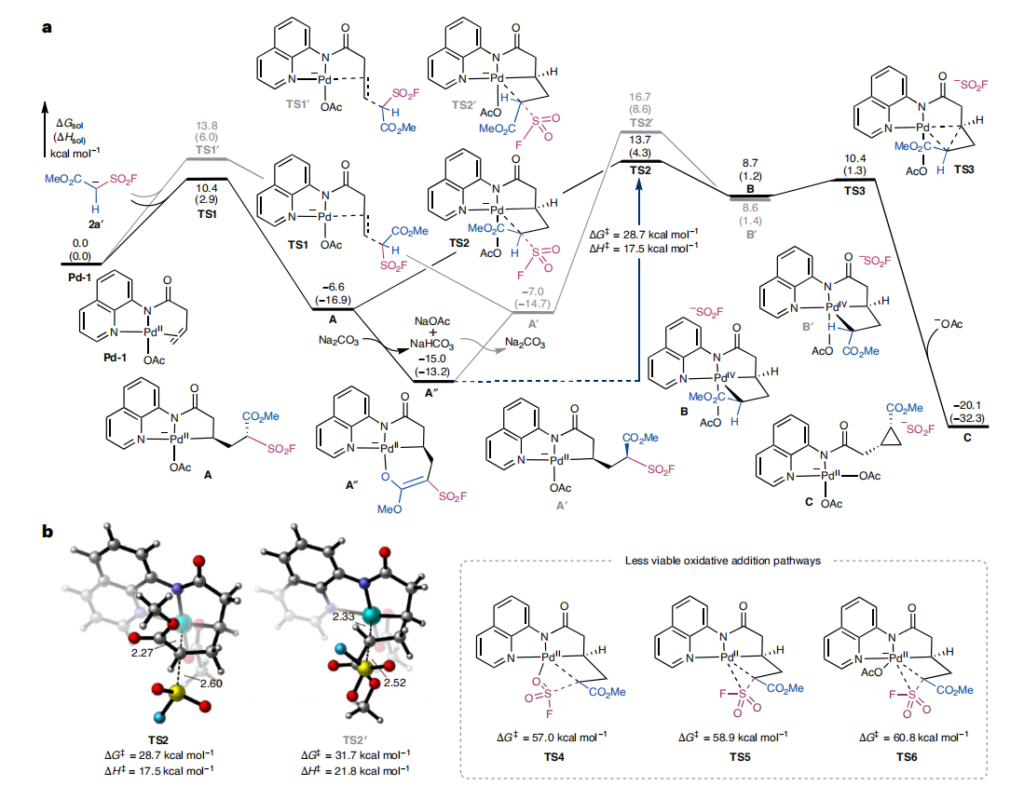
预催化剂乙酸钯与1a发生配体交换,形成π-烯烃钯(II)配合物Pd-1,其中8-氨基喹啉导向基以双齿方式与钯结合。我们考虑了去质子化亲核试剂2a'的两种竞争性反式亲核钯化过渡态(TS1和TS1'),它们分别生成钯杂环中间体的两种非对映异构体(A和A')。基于2a预测的水溶液pKa值(7.75)及类似三氟甲磺酰基的实验pKa值(6.83)51-53,2a去质子化生成2a'的过程应较为容易(详见支持信息图10)。更稳定的过渡态TS1中,亲核试剂上最大的取代基(磺酰氟)与烯烃C=C键处于反式共平面,可最小化空间位阻;而较不稳定的非对映异构过渡态TS1'中,酯基与C=C键处于反式共平面(支持信息图4)。这种空间效应可能导致TS1'的能量比TS1高3.4千卡/摩尔。尽管反式亲核钯化在动力学上有利于钯杂环A的形成,但非对映异构体A和A'可通过酸性α-C–H的去质子化快速差向异构化。碳酸钠介导的A去质子化生成烯醇盐A''的过程,理论计算为放热8.4千卡/摩尔(详见支持信息图5)。该去质子化过程部分由熵驱动——烯醇盐的氧原子取代A中的乙酸酯配体,与钯中心形成六元螯合环。
由于亲核钯化后形成的新α-手性中心会发生差向异构化,在Curtin–Hammett条件下,产物的非对映选择性由后续步骤决定。计算结果表明,氧化加成通过SN2型立体翻转机理进行(TS2和TS2');其他氧化加成路径(包括四中心和三中心C–S氧化加成(TS4-TS6;图5b)及S–F氧化加成16,17(支持信息图6))均不占优势。钯(IV)中间体B的后续还原消除(TS3)动力学上易于进行,相对于B的能垒仅为1.7千卡/摩尔,与我们近期关于张力释放促进钯(IV)还原消除形成环丙烷环的计算研究31一致。释放的磺酰氟阴离子随后分解为二氧化硫(SO₂)气体和氟离子(F⁻),与布尔团队此前的报道22,23类似。原位氟核磁共振(19F NMR)监测表明,氟离子最终转化为二氟氢离子(FHF⁻)(详见支持信息中“氟追踪实验”部分)。
计算的反应能量曲线表明,不可逆的分子内SN2型氧化加成(TS2)是决速步和非对映选择性决定步。从钯-烯醇盐静止态A''到TS2的计算总能垒(ΔG‡=28.7千卡/摩尔,ΔH‡=17.5千卡/摩尔)与实验测定的活化参数定性一致。较大的负活化熵(计算值ΔS‡=-31.7 e.u.,实验值-25.8 e.u.)主要归因于烯醇盐静止态A''质子化时,乙酸酯配体缔合导致的熵损失。计算的非对映选择性表明,通过TS2的SN2型氧化加成生成顺式环丙烷产物的路径,比通过TS2'生成反式产物的次要路径能量低3.0千卡/摩尔,与实验观察到的非对映选择性(>20:1 d.r.)一致。TS2'的不稳定可能源于乙酸酯配体与酯基之间的空间相互作用。苯酯(2f)的SN2型氧化加成能垒升高(ΔG‡=30.9千卡/摩尔),计算的非对映选择性降低(ΔΔG‡=1.2千卡/摩尔),这归因于导向基与酯基之间的空间排斥稳定了生成顺式环丙烷产物的过渡态(支持信息图9)。
结论
本文开发了一种高非对映选择性的钯(II)/钯(IV)催化未活化烯烃与烷基磺酰氟的环丙烷化反应。该方法的合成实用性源于其对多种亲核试剂的广泛兼容性;对于内烯烃,可一步制备传统方法难以获得的全顺式取代环丙烷。动力学实验和DFT计算表明,SN2型氧化加成是反应的决速步和非对映选择性决定步。
Enamine现已储备数百种具备双亲反应性的烷基磺酰氟砌块,满足各类合成需求。