杂质标准品
在药物开发过程中,新药产品的可获得性和质量受到了极大的关注。其中,药物杂质的识别、定量和控制是至关重要的阶段,因为这些杂质的数量直接决定了最终药品的安全性。不同国家和地区的药典(如美国药典 USP、欧洲药典 EP、英国药典 BP、日本药典JP和中国药典 ChP)对活性药物成分(APIs)和药物制剂中的杂质含量设定了严格的限制。
Enamine 拥有精确记录的科学专长,在有机合成和分析化学领域具备深厚的专业知识,这使我们能够合成并识别以前未被识别的杂质。我们的目录中包含 692 种现货药物杂质参考标准品,并为所有化合物提供详细的分析证书(Certificate of Analysis, CoA),这些证书包含了通过核磁共振(NMR)、高效液相色谱-质谱联用(HPLC/MS)和气相色谱-质谱联用(GC/MS)方法验证的明确的身份和纯度数据。
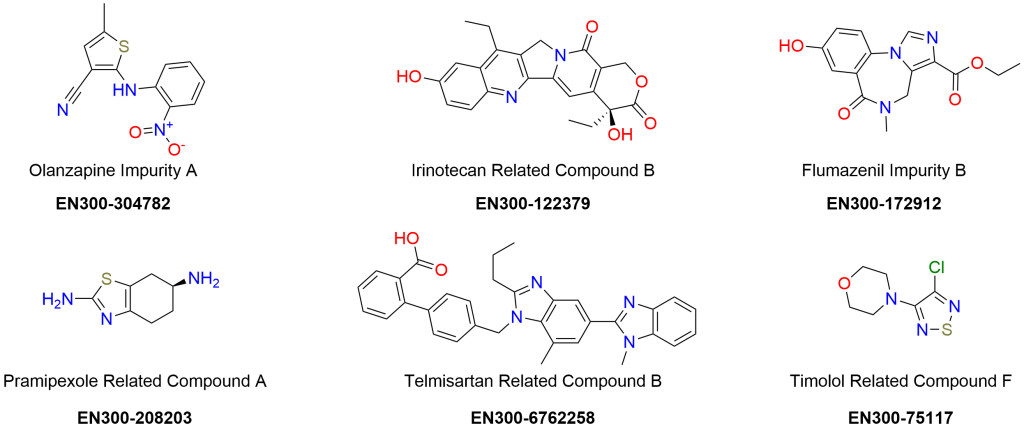
药物杂质分析
Enamine 提供专业的 API(活性药物成分)杂质分析服务,旨在识别生产过程中可能出现的杂质。我们对生产过程中的每一个步骤进行详细调查,评估所有可能涉及的化合物或溶剂,以确定其是否可能导致杂质或降解产物的形成。通过这种全面的分析,我们可以可靠地预测未知杂质的结构,识别其生成机制,并制定战略性的杂质管理方案。
定制合成
Enamine 的核心竞争力和竞争优势在于合成路线的设计。我们不需要现成的合成程序文件即可生产您感兴趣的化合物。在大多数情况下,我们可以从零开始提出一个现实可行的合成方案,并成功实现该方案,以生产出所需纯度的化合物(从毫克到克级别)。这种能力使我们在定制合成领域具有显著的竞争优势。