蛋白质拟态化合物库
能够模拟常见蛋白质结构的精选分子
8 960 种化合物
在人体蛋白质组中发现了 250 000 多种单独的蛋白质-蛋白质相互作用(PPIs)。尽管其中许多表现出复杂的拓扑结构和庞大的表面区域,但在许多情况下,成功的结合是通过有限数量的关键残基(“热点”)实现的。多篇文献报道了开发小分子调节蛋白质相互作用(PPIs)的计算和多样性导向的方法。其中,非肽类 α-螺旋和 β-转角模拟物尤为重要,因为它们在导致癌症、神经退行性疾病、炎症和免疫疾病等多种失调通路中起关键作用。
典型格式
蛋白质拟态化合物库可以提供各种预装板(pre-plated)格式,包括以下最受欢迎的几种:
| 目录号 | 化合物数量 | 规格 | 储存形式 | 价格 |
| PML-8-0-Z-10 | 8 960 7块板 |
≤300nL@10mM DMSO溶液 |
1536孔Echo LDV微孔板 前4列和后4列留空,每板1280个化合物 |
立即询价 |
| PML-8-10-Y-10 | 8 960 28块板 |
≤10µL@10mM DMSO溶液 |
384孔LDV微孔板,Echo认证#001-12782 (LP-0200) 前2列和后2列分别留空,每板320个化合物 |
立即询价 |
| PML-8-50-Y-10 | 8 960 28块板 |
50µL@10mM DMSO溶液 |
384孔板(Greiner Bio-One plates #781280) 第1、2和23、24列留空,每板320个化合物 |
立即询价 |
| 化合物库 & 后续跟进包: | PML-8-10-Y-10 筛选库 8 960 个化合物 hit 再补给,类似物从 440 多万库存中获取或从 REAL 空间合成 |
|||
* 我们很乐意以最方便您项目的格式提供我们的化合物库。请在以下我们标准的微孔板中进行选择:Greiner Bio-One 781270、784201、781280、651201 或 Echo Qualified 001-12782 (LP-0200)、001-14555 (PP-0200)、001-6969 (LP-0400)、C52621,或者您可以提供您偏好的实验器具。如需化合物混合池,我们也可以根据要求提供。
库的设计
传统的三残基方法
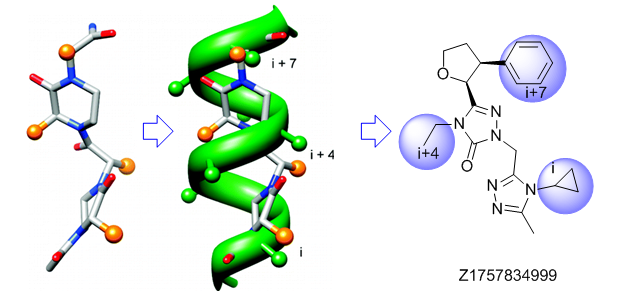
α-螺旋模拟物
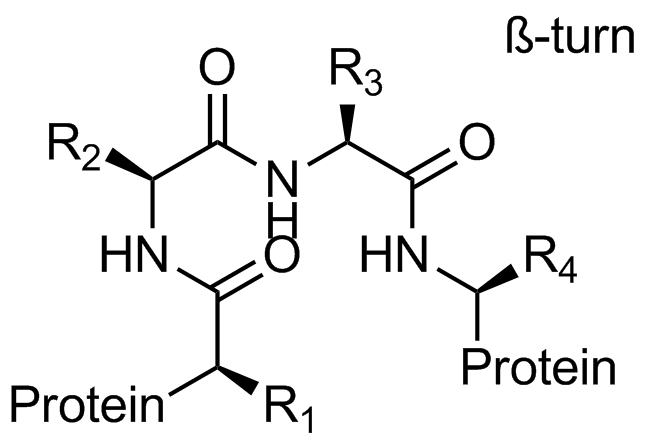
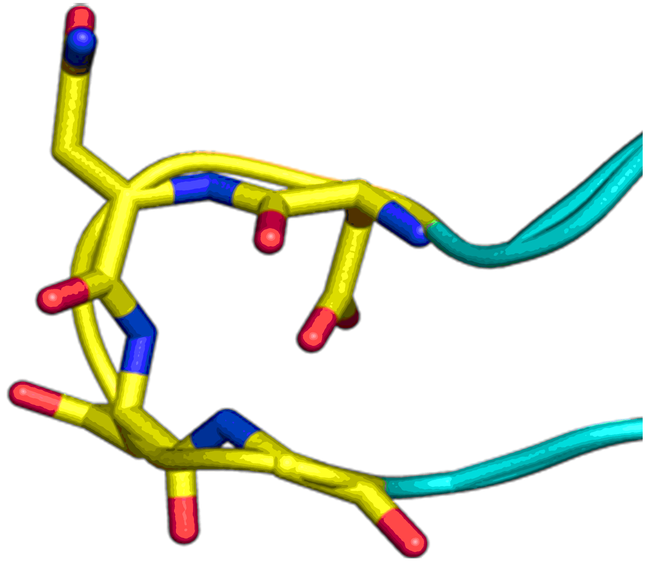
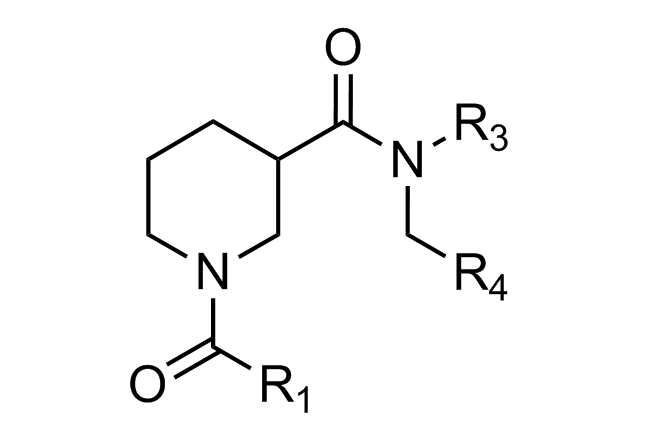
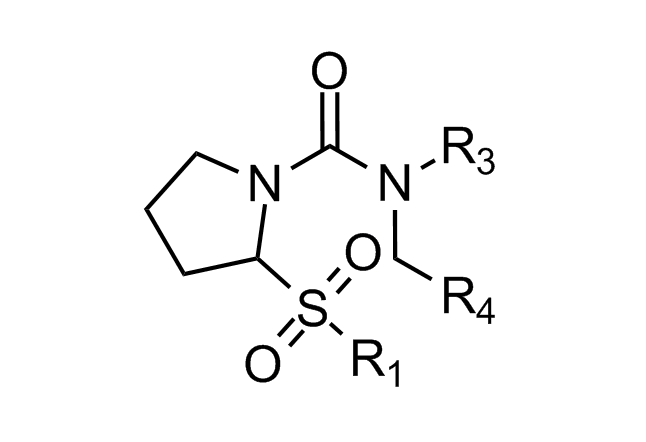
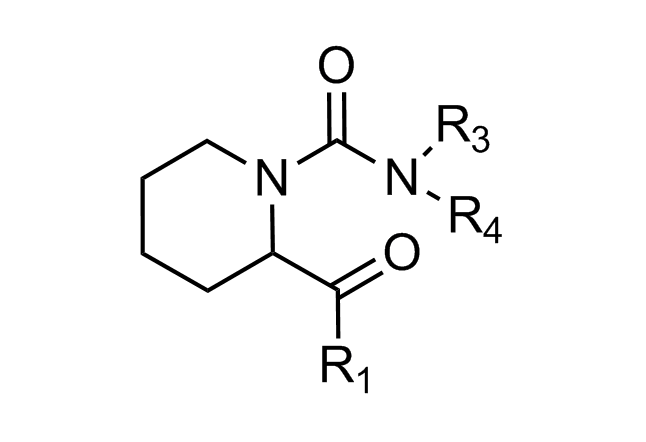
β-折叠模拟物
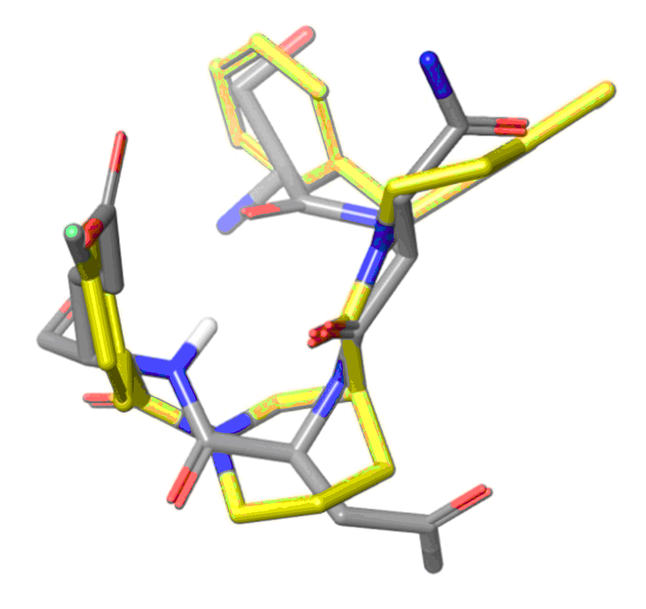
基于配体的方法
基于靶点的方法。我们设计了针对选定的 α-螺旋和 β-转角的化合物集,如 mdm2-p53、mdm2-CK1α、HIF1-α、MEF2-HDAC4、HIV-1 gp41、CD81/CV、Bcl-2/Bcl-xL 等。通过虚拟筛选后,我们优先选择了承载新化学类型的结构。
“传统”三残基方法包括具有不寻常核心化合物的设计,这些核心带有常规的关键残基,可模拟位于一个识别面(“热点”)上的 i,i+3/i+4 和 i+7 残基。在对 α-螺旋界面进行建模时,我们还考虑了双面螺旋模拟物。对于 β-转角模拟物,我们应用了三种具有不同类型相互作用的查询模型:π-π 堆叠、阳离子-π 和氢键相互作用以及 S-π 相互作用:后者重点设计的实例是对 Bim BH3 结构域与 Mcl-1 和 Bcl-2 之间相互作用的建模,并鉴定具有高 Fsp3 特性的融合多氢化合的氮杂环。
基于配体的方法。选择了拓扑结构接近已知 α-螺旋和 β-折叠模拟物的新化学型。基于形状的相似性和药效团筛选被用作化合物库设计的主要工具。
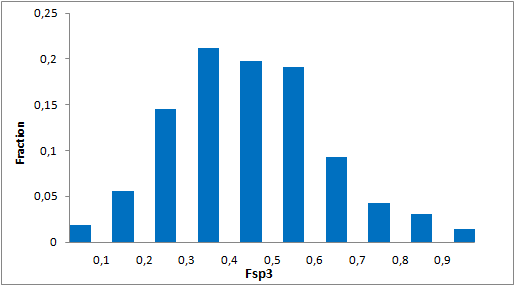
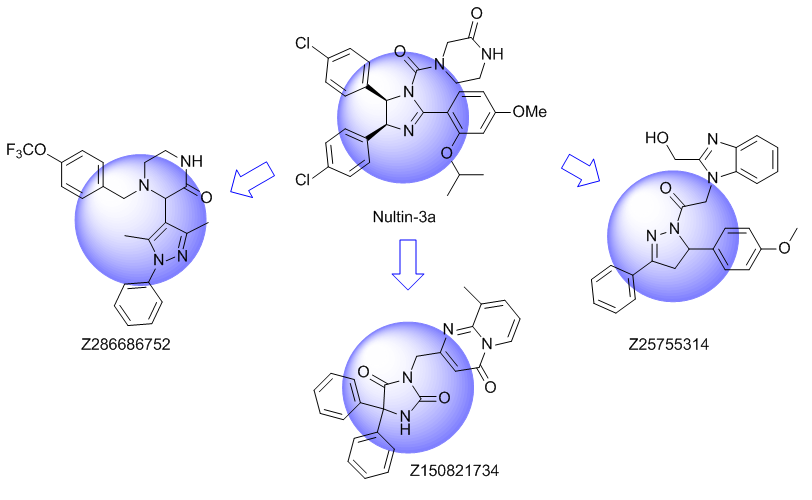
我们特别选择了独特的富含 Fsp3 的骨架,其中包含阶梯状的环状骨架,以增强与靶标 α-螺旋和 β-转角基序的拓扑结构和药效团相互作用。
化合物中选择的骨架示例
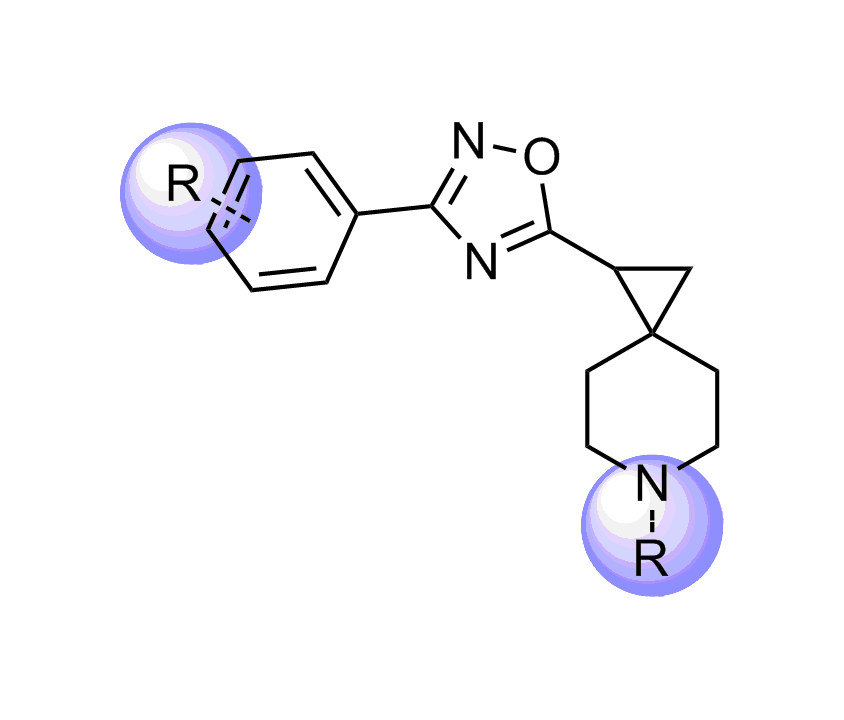
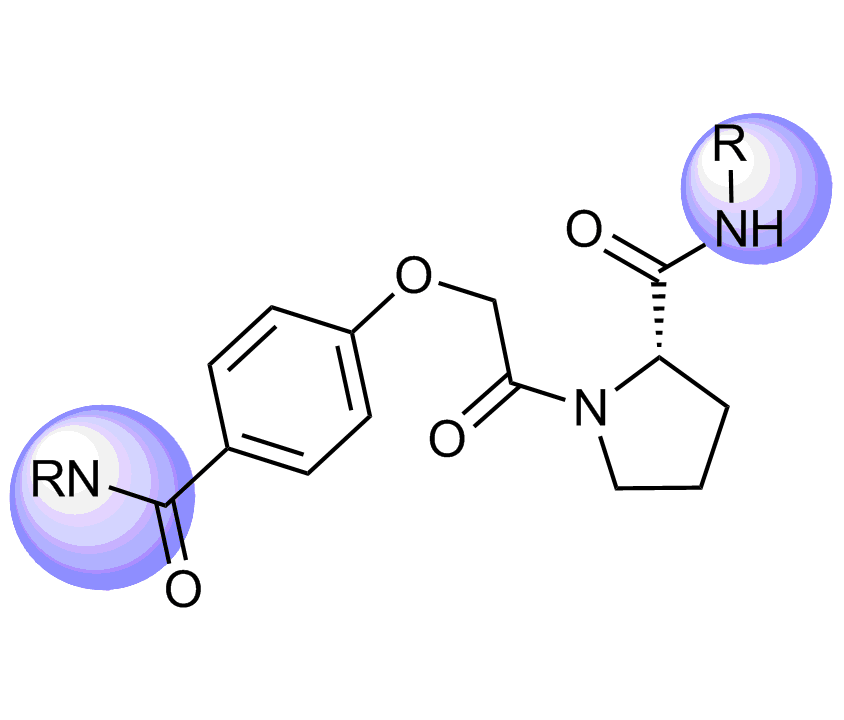
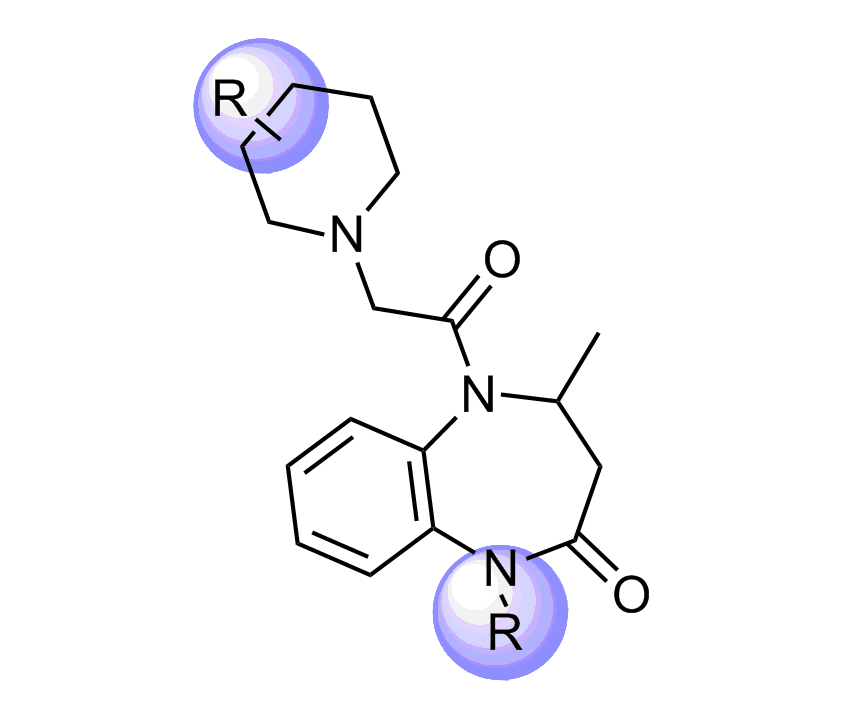
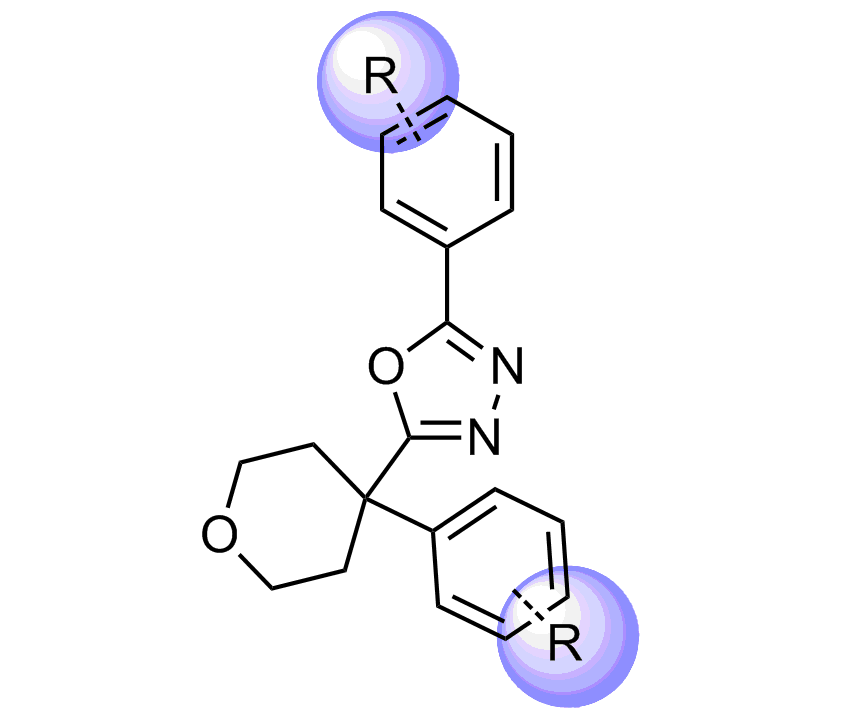
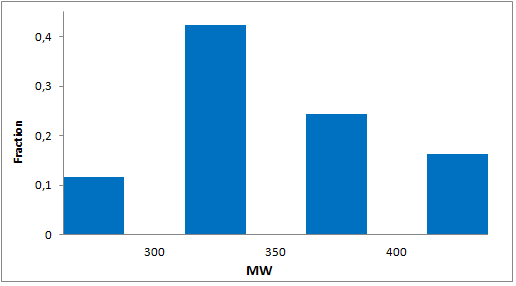
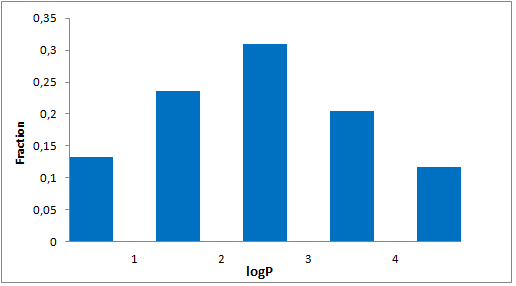
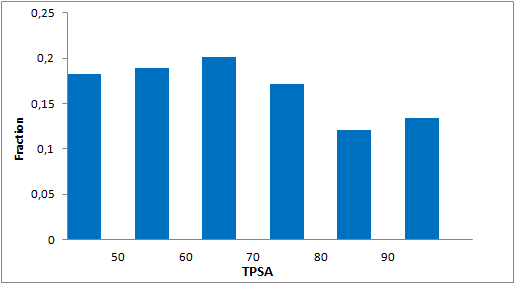
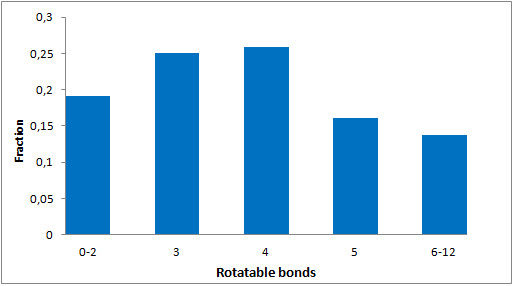
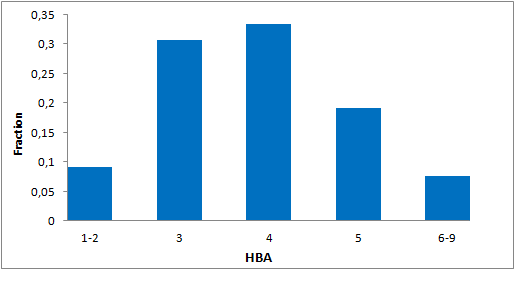
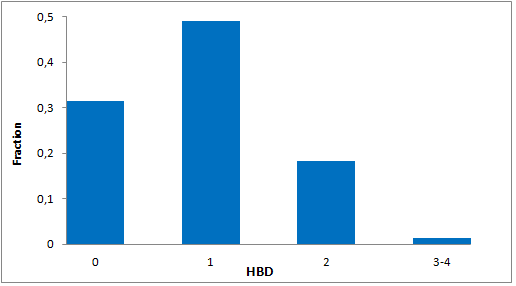
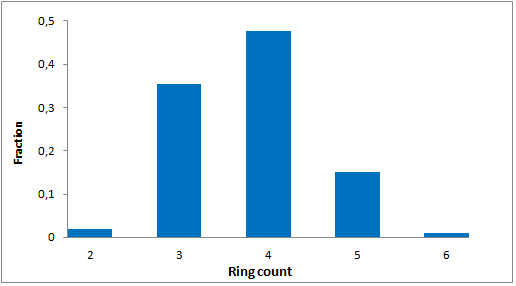
分子特性