在药物研发领域,“氟原子” 堪称优化药物性能的 “神奇工具”—— 它能精准调节药物分子的酸碱性、亲脂性和极性,让候选药物更易抵达靶点、发挥疗效。近期,Enamine科学研究所发表一项研究,就围绕含氟药物的核心难题取得新进展:科学家成功实现了 “5,5-二氟八氢戊搭烯-2-胺” 的克级合成,并证实这类分子能成为药物设计中常用环己烷结构的优质替代物,为新药研发提供了关键 “建筑积木”。
为什么聚焦 “偕二氟双环分子”?
含氟化合物早已是药物界的 “常客”:抗 HIV 药物Maraviroc、抗糖尿病药物Gosogliptin、抗癌药Ivosidenib等上市药物,都依赖氟原子优化的分子结构。其中,“偕二氟(gem-CF₂)饱和环系” 是备受青睐的药物单元——它能在不破坏分子整体构象的前提下,提升药物与靶点的结合能力,还能改善药物在体内的吸收和代谢。

不过,现有研究存在明显短板:多数偕二氟化合物是单环结构,双环结构(如双环 [m.n.0] 烷衍生物)的研究十分有限。尤其是 “5,5-二氟八氢戊搭烯” 这类双环分子,虽在部分专利中被提及,却一直缺乏明确的科学合成方法,其关键理化性质也无人探究。更重要的是,这类双环结构有望成为 “4,4-二氟环己烷” 的 “升级版替代物”—— 通过延长环系,让药物分子更贴合靶点蛋白的结合口袋,进一步提升药效。
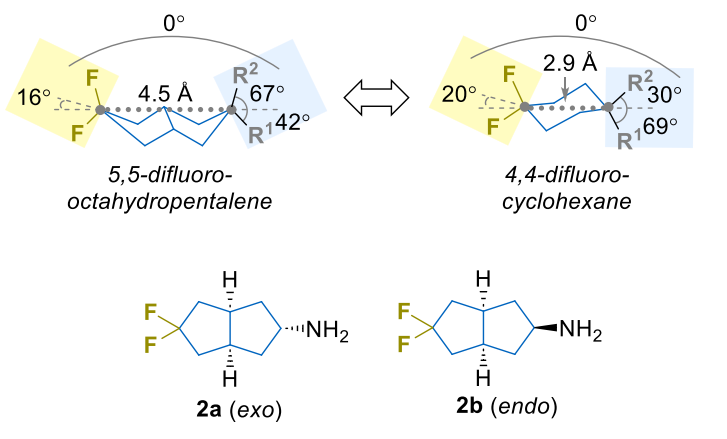
为填补这一空白,来自Enamine 公司和乌克兰基辅国立大学的团队,针对性开发了这类分子的高效合成路线,并系统分析了其理化性质。

克级合成:从商用原料出发的高效路线
研究团队选择 “商用Weiss二酮” 作为起始原料——这种化合物易得且结构稳定,为规模化合成奠定了基础。整个合成过程的核心,在于 “精准控制分子立体结构” 和 “高效引入偕二氟基团”:
立体控制是关键:通过 “NaBH₄选择性还原” 和 “Mitsunobu反应构型翻转” 两步核心操作,团队成功控制了分子的空间结构,分别得到 “外消旋(exo-)” 和 “内消旋(endo-)” 两种异构体——这两种构型的分子在与靶点结合时可能表现出不同活性,为后续药物筛选提供了更多选择。
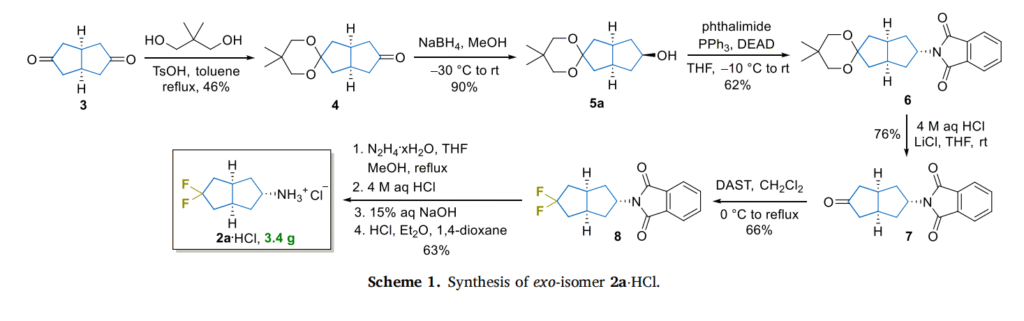
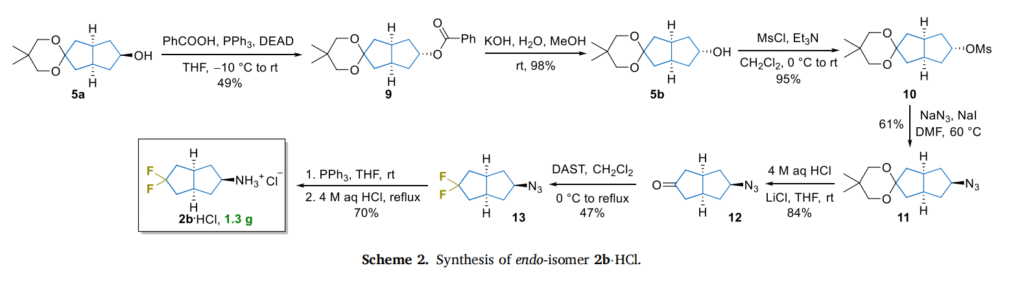
偕二氟引入有巧思:采用经典的 “DAST介导脱氧氟化” 技术,将偕二氟基团(CF₂)精准嵌入双环结构中,反应虽需回流条件,但过程平稳且收率可观(约 67%)。
克级规模易实现:整个合成路线可放大至 “多克级”,单批次就能得到 3.4 克外消旋目标产物(盐酸盐形式),收率达 63%——这一效率完全能满足后续药物研发中 “大量合成测试样品” 的需求。
同时,团队还合成了这类分子的 “非氟类似物”,用于对比氟原子对分子性质的影响,让研究结论更具说服力。
理化性质揭秘:为何适合做药物替代物?
药物分子的 “酸碱性(pKa)” 和 “亲脂性(LogP)” 是决定其药效的关键 ——pKa 影响药物在体内的解离状态,LogP 则关系到药物能否穿透细胞膜、与靶点结合。团队通过实验测定,清晰揭示了目标分子的性质优势:
1. 氟原子让碱性 “恰到好处”
偕二氟取代会降低分子的碱性:外消旋二氟分子(2a)的 pKa 比非氟类似物低 1.0 个单位,内消旋二氟分子(2b)低 0.4 个单位。这一变化与 “4,4-二氟环己烷” 的碱性变化(ΔpKa=1.2)接近,说明双环结构中,氟原子的 “远程吸电子效应” 能高效传递——即便双环距离更长,但刚性环系反而增强了电子传导,类似吗啡烷衍生物的 “长程取代效应”。这种适度降低的碱性,能让药物在体内更易保持 “非解离状态”,从而穿透细胞膜。
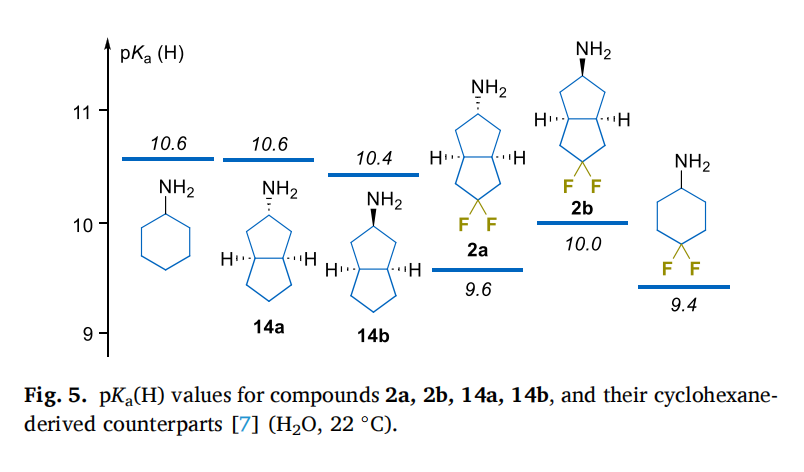
更难得的是,外消旋与内消旋异构体的 pKa 差异很小(仅 0.2-0.4 个单位),意味着在药物设计中,无需过度纠结构型对碱性的影响,可更聚焦于分子与靶点的空间匹配。
2. 亲脂性 “可控”,避免药物 “难吸收” 或 “易蓄积”
亲脂性过高的药物易在脂肪中蓄积,过低则难穿透细胞膜。目标分子的亲脂性表现堪称 “理想”:
偕二氟取代能降低亲脂性:二氟分子的 LogP 比非氟类似物低 0.51-0.58 个单位,抵消了 “双环比单环多 1 个碳原子” 带来的亲脂性提升(双环分子 LogP 比环己烷高约 0.5 个单位)。这种 “一升一降” 的平衡,让分子亲脂性恰好落在药物设计的 “黄金区间”(通常 1-3),既易穿透细胞膜,又不易在体内蓄积。
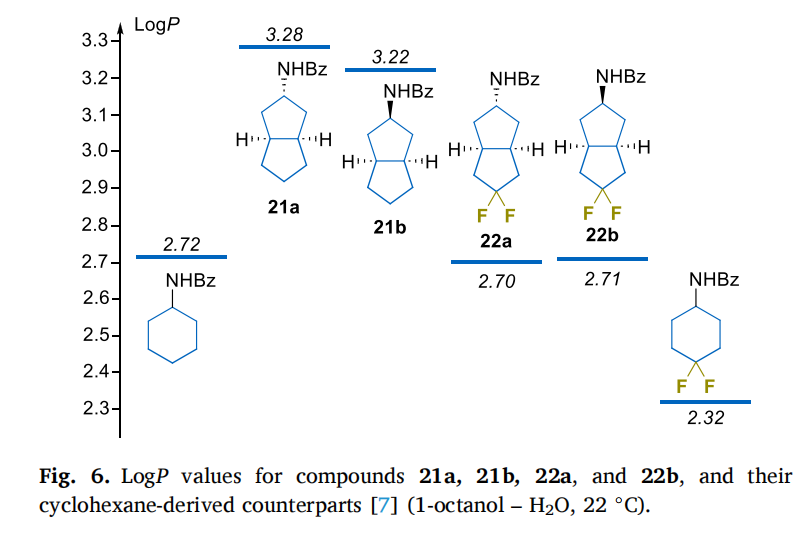
- 构型对亲脂性影响可忽略:外消旋与内消旋异构体的 LogP 几乎无差异,进一步降低了药物筛选的复杂度。
未来可期:为新药研发添 “新积木”
这项研究的意义,远不止 “合成一种新分子”——它首次明确了 “5,5-二氟八氢戊搭烯-2-胺” 的高效合成路线,证实了这类双环分子可作为 “4,4-二氟环己烷” 的优质替代物,为药物化学家提供了新的 “结构工具”。对于药物研发领域而言,每一种新型 “优质构建单元” 的发现,都可能成为突破现有药物瓶颈的关键 —— 这项来自Enamine的研究,无疑为含氟药物的创新开辟了新方向。
关键中间体的合成方法:
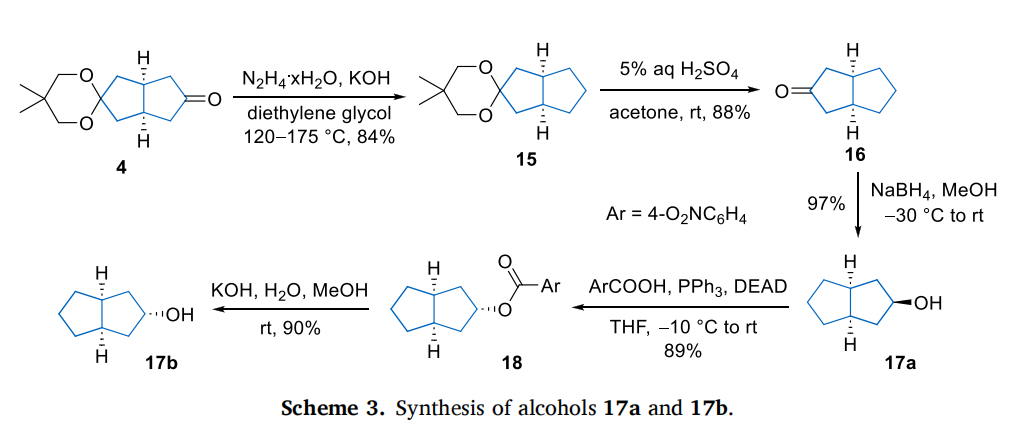
酮 4 和 16 还原制备醇 5a(内消旋)和 17a(内消旋)
向相应酮 4 或 16(0.100 mol)的甲醇(300 mL)溶液中,在 - 25~-30℃下分批加入固体 NaBH₄(7.58 g,0.200 mol)(注意:建议缓慢加入以避免放热反应)。混合物在该温度下搅拌 1 小时,随后移除冷却浴,在室温下继续搅拌 1 小时。然后,滴加 4.5 mol/L 氢氧化钠水溶液(约 150 mL),期间偶尔用水浴冷却。反应混合物减压浓缩至原体积的 1/3,残余物用乙酸乙酯(3×200 mL)萃取。合并有机相,用无水硫酸钠干燥后减压浓缩,得到相应的醇,无需进一步纯化即可直接用于后续反应。
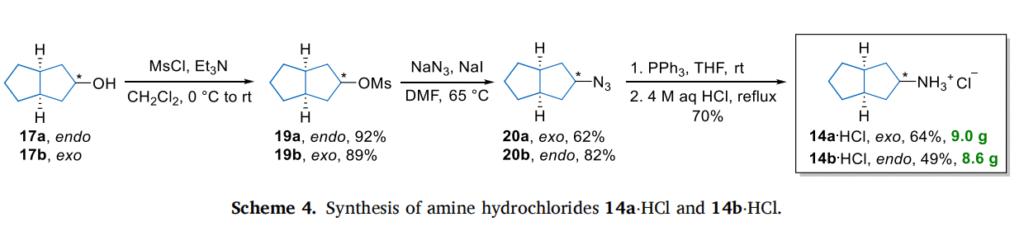
偕二氟取代八氢戊搭烯 8 和 13 的合成
向预冷却至 0℃的相应酮 7 或 12(1 mmol)的二氯甲烷(5 mL)溶液中,滴加 DAST(485.0 mg,3 mmol)的二氯甲烷(2 mL)溶液,维持内部温度不变。滴加完毕后,将反应混合物加热至温和回流并搅拌过夜(化合物 8 需延长至 2 天)。通过对反应混合物小量取样进行 1H 和 19FNMR 分析监测反应进度,必要时补加 DAST(1 mmol)。反应完成后,将混合物倒入 5% 碳酸氢钠水溶液(5 mL)中(注意:可能发生剧烈反应!强烈建议缓慢加入并偶尔冷却),搅拌 15 分钟。分离有机相,水相用二氯甲烷(2×7 mL)反萃取。合并有机相,用无水硫酸钠干燥后减压浓缩。残余物通过快速柱色谱(化合物 13)或用乙醇(15 mL)研磨(化合物 8)纯化,得到目标化合物。
Enamine 目前对文中提及的exo-5,5 - 二氟八氢戊搭烯 - 2 - 胺与endo-5,5 - 二氟八氢戊搭烯 - 2 - 胺均提供现货供应,可快速响应需求。此外,我们还备库数百种含不同官能团的戊搭烯衍生物,为您的研发提供更多选择,欢迎通过官网查询详细信息。