蛋白质结合物通常含有亲脂性基团,与蛋白质内部的疏水表面相互作用。然而,将这些基团纳入候选药物中通常会导致代谢稳定性降低,这对将有效的生物活性分子推向临床构成了重大挑战。螺环基团为这个问题提供了一个可行的解决方案。
疏水性螺环分子在药物开发中因其独特的结构和性质发挥着重要作用,尤其在改善药物代谢稳定性、靶标结合亲和力及类药性方面表现突出。以下是其核心作用及具体应用:
1、增强代谢稳定性
• 降低氧化代谢:螺环结构的刚性可减少细胞色素P450酶的攻击位点,延长半衰期。例如,抗丙肝药物格卡瑞韦(Glecaprevir)中的螺环结构减少了肝代谢降解。
• 减少构象自由度:限制分子柔性,降低酶解概率,提高口服生物利用度。
2、优化药物-靶标相互作用
• 三维结合优势:螺环的立体结构可精准匹配靶蛋白的疏水口袋,增强结合力。如JAK1/2抑制剂巴瑞替尼(Baricitinib)的螺环部分与ATP结合位点形成疏水相互作用。
• 诱导契合效应:螺环的刚性可能诱导靶蛋白构象变化,提高选择性(如激酶抑制剂设计)。
3、改善溶解性与渗透性
• 平衡亲脂性:疏水性螺环可调节logP值,优化膜渗透性(如中枢神经系统药物需穿透血脑屏障)。
• 共晶策略:通过形成药物-共晶(如与环糊精)改善水溶性,避免生物利用度下降。
4、克服耐药性
• 空间位阻效应:螺环的立体阻碍可防止靶蛋白突变导致的药物逃逸,如某些HIV蛋白酶抑制剂和抗生素(如利奈唑胺衍生物)。
案例应用
抗癌药物:如CDK4/6抑制剂帕博西尼(Palbociclib)的螺环哌啶结构增强激酶抑制活性。
抗病毒药物:前述格卡瑞韦通过螺环结构实现长效抗病毒。
神经疾病药物:螺环季铵盐(如某些抗癫痫药)可平衡脂溶性与血脑屏障穿透。
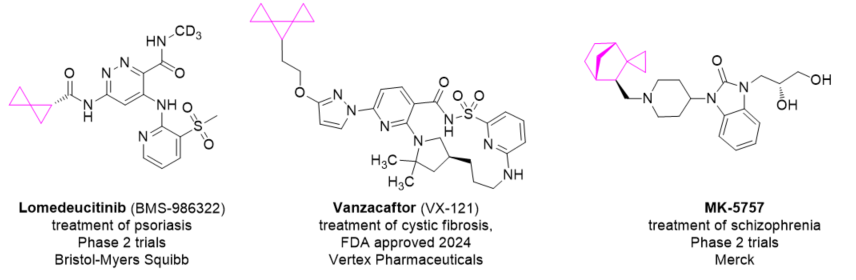
还有下面所示的TYK2抑制剂Lomedeucitinib,新型囊性纤维化跨膜电导调节剂 (CFTR) Vanzacaftor和PDE10A抑制剂MK-5757。
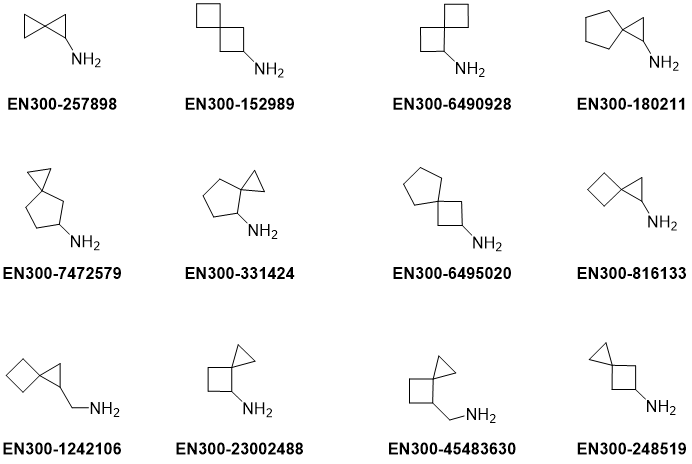
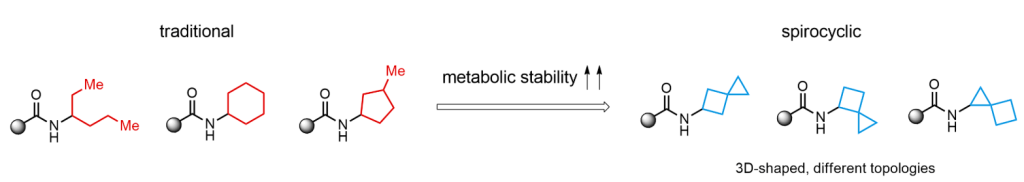
我们Enamine基于下面理念,设计了100多个螺环胺。Enamine的螺环基团集合具有不同的环尺寸和分子拓扑结构,如螺烷基胺的集合代表。
实例